La pression partielle d'un gaz parfait i dans un mélange de gaz parfaits de pression totale  est définie comme la pression
est définie comme la pression  qui serait exercée par les molécules du gaz isi ce gaz occupait seul tout le volume offert au mélange, à la température de celui-ci. Elle correspond donc à la contribution de ce gaz i à la pression totale du mélange.
qui serait exercée par les molécules du gaz isi ce gaz occupait seul tout le volume offert au mélange, à la température de celui-ci. Elle correspond donc à la contribution de ce gaz i à la pression totale du mélange.

 par l'intermédiaire de la fraction molaire
par l'intermédiaire de la fraction molaire 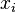 du constituant considéré dans le mélange : et la pression totale
du constituant considéré dans le mélange : et la pression totale
 est définie comme la pression
est définie comme la pression  qui serait exercée par les molécules du gaz isi ce gaz occupait seul tout le volume offert au mélange, à la température de celui-ci. Elle correspond donc à la contribution de ce gaz i à la pression totale du mélange.
qui serait exercée par les molécules du gaz isi ce gaz occupait seul tout le volume offert au mélange, à la température de celui-ci. Elle correspond donc à la contribution de ce gaz i à la pression totale du mélange.Définition mathématique
La loi de Dalton, valable rigoureusement pour un mélange idéal de gaz parfaits, relie la pression partielle
 par l'intermédiaire de la fraction molaire
par l'intermédiaire de la fraction molaire 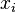 du constituant considéré dans le mélange : et la pression totale
du constituant considéré dans le mélange : et la pression totale 
- où
 est le nombre de môles d'un constituant quelconque repéré par l'indice
est le nombre de môles d'un constituant quelconque repéré par l'indice  dans le mélange et
dans le mélange et  le nombre total de môles dans le mélange.
le nombre total de môles dans le mélange.
- La pression partielle du constituant i est égale au produit de sa fraction molaire par la pression totale.


- car
 .
.
